Качественные реакции на аминогруппу. Реакции, протекающие с одновременным участием карбоксильной и аминной групп
Декарбоксилирование
Декарбоксилирование карбоновых кислот легко протекает, если в a-положении к карбоксилу находится электроноакцепторная группа как, например, СООН, NO 2 , CCl 3 и другие. В аминокислотах таким электроноакцептором служит аммониевая группа NH 3 + . Реакцию осуществляют при нагревании a-аминокислот в присутствии солей Cu(II) и поглотителей углекислого газа .
В живых организмах этот процесс протекает под действием ферментов - декарбоксилазы и пиридоксальфосфата и приводит к образованию биогенных аминов.
Этерификация
Этерификация аминокислот спиртами катализируется газообразным хлороводородом. Образующиеся при этом аммониевые соли сложных эфиров аминокислот превращают в нейтральные соединения, действуя на них органическими основаниями, например, триэтиламином.
Образование амидов
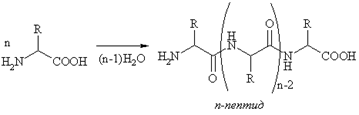
Наличие двух функциональных групп в молекуле аминокислоты обусловливает реакцию межмолекулярного ацилирования с образованием амидов. Образующаяся связь называется пептидной, а соединения - пептидами или полипептидами.

> Специфические свойства
Отношение аминокислот к нагреванию
Аминокислоты с различным взаимным расположением амино- и карбоксильных групп при нагревании ведут себя различно. a-Аминокислоты димеризуются и образуют циклические продукты - дикетопиперазины. При этом протекает взаимное ацилирование аминогруппы одной молекулы аминокислоты карбоксильной группой другой молекулы.

g-Аминокислоты при нагревании превращаются в лактамы - продукты внутримолекулярного ацилирования аминогруппы карбоксилом.


b-Аминокислоты отщепляют молекулу аммиака и дают a, b-непредельные кислоты.
Нингидринная реакция (реакция Руэманна)
При кратковременном нагревании a-аминокислот с нингидрином в воде наблюдается изменение окраски раствора с бесцветного на фиолетовый за счет образования нингидринного пигмента (пурпура Руэманна). Эта качественная реакция используется для визуальной идентификации a-аминокислот на тонкослойных и бумажных хроматограммах.

Образование комплексов
a-Аминокислоты образуют с катионами металлов внутрикомплексные соли. Например, глицин реагирует со свежеосажденным гидроксидом меди, давая синий раствор глицината меди.

Ароматические аминокислоты
Подобно ариламинам ароматические аминокислоты алкилируются, ацилируются и диазотируются по аминогруппе. Аналогично другим замещенным карбоновым кислотам, ароматические аминокислоты превращаются в сложные эфиры и амиды по карбоксильной группе. Обратим внимание на некоторые специфические свойства антраниловой кислоты, позволяющие использовать ее в органическом синтезе. Так, она является исходным соединением в одном из самых удобных методов генерации дегидробензола. Диазотирование антраниловой кислоты алкилнитритами дает цвиттер-ионную соль диазония, которая термически или фотохимически разлагается с образованием дегидробензола.
Аминокислоты можно алкилировать по аминогруппе галоидными алкилами (обычно иодистыми алкилами). Например, алкилированием глицина можно получить метиламиноуксусную кислоту саркозин, которая в связанном виде содержится в некоторых белках.
При избытке иодистого метила образуется четвертичная аммонийная соль:
3. Действие азотистой кислоты (дезаминирование in vitro).
Реакция протекает так же, как и при взаимодействии с азотистой кислотой алифатических первичных аминов выделяется азот, а аминогруппа замещается на гидроксильную группу:
Таким образом можно установить структурное родство аминокислот с соответствующими оксикислотами. По объёму выделившегося азота определяют количество α-аминокислоты, вступившей в реакцию (метод Ван-Слайка).
4. Взаимодействие с альдегидами.
α-Аминокислоты, подобно первичным аминам, реагируют с альдегидами, образуя замещенные имины (основания Шиффа). Реакция протекает через стадию образования карбиноламинов.

При взаимодействии α-аминокислот с формальдегидом образуются относительно устойчивые карбиноламины N-метилольные производные, свободная карбоксильная группа которых может быть оттитрована щелочью.
Формальдегид, взятый в избытке, способствует отщеплению протона от NH 3 + группы биполярного иона и легко соединяется со свободной (непротонированной) аминогруппой, образуя устойчивое метилольное производное.

Титрование аминокислоты в избытке формальдегида (формольное титрование) представляет собой аналитический метод (метод Серенсена), при помощи которого прослеживается, в частности, образование свободных аминокислот в процессе гидролиза белков.
5. Взаимодейстивие с динитрофторбензолом (днфб).
Важной реакцией α-аминогруппы является её реакция с 2,4-динитрофторбензолом (ДНФБ) в слабощелочном растворе, которую впервые использовал Фредерик Сенгер для количественного введения метки в аминогруппы аминокислот и пептидов. Эта реакция протекает по механизму нуклеофильного замещения.
Продукт реакции окрашен в интенсивно желтый цвет. Эта реакция представляет исключительную ценность для идентификации N-концевых аминокислот полипептидных цепей.
Все вышеперечисленные реакции аминогруппы аминокислот можно представить следующей схемой:

Реакции функциональных групп, содержащихся в радикалах аминокислот
Аминокислоты вступают также в реакции, типичные для функциональных групп, присутствующих в их радикалах. Например для SH-групп цистеина, гидроксильной группы тирозина и треонина, гуанидиновой группы аргинина.
1. Реакции сульфгидрильной (тиоловой) группы.
Для сульфгидрильной группы характерна исключительно высокая реакционная способность. Например, при действии на цистеин незначительных концентраций ионов некоторых тяжелых металлов образуются меркаптиды.
В щелочных растворах цистеин легко теряет атом серы. Так, при нагревании цистеина с ацетатом свинца в щелочном растворе образуется черный осадок сульфида свинца. Эта реакция применяется для обнаружения сульфгидрильной группы в пептидах и белках.
Тиоловая группа цистеина легко подвергается окислению с образованием дисульфида. Этот процесс можно отразить следующей схемой:
Дисульфидные связи, присоединяя два атома водорода, переходят в сульфгидрильные (тиоловые) группы:
Рассмотрим этот процесс на примере превращения цистеина в цистин:

В цистине при действии восстановителей дисульфидная связь разрывается и образуется две молекулы цистеина:

Д исульфидная
связь может также подвергаться окислению
под действием таких жестких окислителей,
как например над-
исульфидная
связь может также подвергаться окислению
под действием таких жестких окислителей,
как например над-
муравьиная кислота (). В результате образуется цистеиновая кислота:

При нагревании -аминокислоты, а еще легче их эфиры образуют циклические амиды, называемыедикетопиперазинами:
-Аминокислоты при нагревании отщепляют аммиак и образуют непредельные кислоты:

При нагревании ,и-аминокислот образуются внутренние циклические амиды –лактамы:
Биохимические превращения аминокислот
Избыток аминокислот в организме разрушается при помощи реакций, которые снабжают клетку энергией. Для биологических превращений -аминокислот, осуществляемых в организме (invivo) под действием различных ферментов, характерны следующие реакции: переаминирование (трансаминирование), дезаминирование и декарбоксилирование.
Переаминирование играет ведущую роль в процессе биосинтеза аминокислот в растениях. Оно заключается во взаимном превращении аминогрупп и карбонильных групп под действием ферментов трансаминаз:

Реакция переаминирования является связующим звеном между процессами метаболизма белков (-аминокислоты) и углеводов (-оксокислоты). С помощью этой реакции регулируется содержание-аминокислот в клетках.
Наиболее распространенной и важной реакцией аминокислот по -аминогруппе являетсядезаминирование. Кроме аммиака, продуктами дезаминирования являются карбоновые кислоты, гидроксикислоты и оксокислоты. Дезаминирование может происходить как окислительным, так и неокислительным путем.Неокислительное дезаминирование встречается, в основном, у бактерий и грибов. Например, превращение аспарагиновой кислоты в фумаровую под действием фермента аспартазы:

Наиболее преобладающим является окислительное дезаминирование, которое протекает в две стадии. Сначала аминокислота под действием фермента дегидрогеназы окисляется в неустойчивую промежуточную иминокислоту, которая в присутствии воды превращается в кетокислоту и аммиак:

Процесс отщепления карбоксильной группы аминокислот в виде СО 2 получил названиедекарбоксилирования. Декарбоксилирование аминокислот осуществляется сравнительно легко в тканях животных и растений, но особенно широко оно представлено у микроорганизмов. Реакции декарбоксилирования являются необратимыми, катализируются ферментами – декарбоксилазами аминокислот, продуктами реакции являются амины:

Эти амины обладают высокой физиологической активностью и их называют биогенными аминами. Например, при декарбоксилировании гистидина образуется гистамин, который вызывает усиление деятельности желез внутренней секреции и снижает кровяное давление:

Полипептиды
Полипептиды –
это амиды, образовавшиеся
в результате взаимодействия аминогрупп
и карбоксильных групп отдельных
аминокислот. Амидная связь в
этих соединениях называетсяпептидной
связью.
В зависимости от числа
аминокислотных остатков, входящих в
молекулу пептида, различают дипептиды,
трипептиды, тетрапептиды и т.д. вплоть
до полипептидов.
в
этих соединениях называетсяпептидной
связью.
В зависимости от числа
аминокислотных остатков, входящих в
молекулу пептида, различают дипептиды,
трипептиды, тетрапептиды и т.д. вплоть
до полипептидов.
Последовательность соединения остатков аминокислот в молекуле пептида влияет на его свойства. Так, при взаимодействии двух аминокислот возможно образование четырех дипептидов, различающихся по своим физическим и химическим свойствам. Например, при взаимодействии глицина (Гли) и аланина (Ала) могут образоваться следующие дипептиды:

Всякая линейная пептидная цепь имеет на одном конце свободную аминную, а на другом конце – свободную карбоксильную группы. Аминокислотный остаток со свободной аминогруппой (в природных белках это -аминогруппа) называетсяN -концевым ; остаток, содержащий свободную карбоксильную группу, носит названиеС-концевого. Название полипептида составляется из названий входящих в его состав аитнокислот, которые перечисляются последовательно, начиная сN-концевого остатка. При этом суффиксин в названиях аминокислот заменяется суффиксомил , и только С-концевая аминокислота сохраняет суффиксин . Например, в приведенном ниже тетрапептиде
![]()
глицин является N-концевой аминокислотой, а валин – С-концевой аминокислотой.
Полипептиды встречаются в организмах животных и человека, являясь, чаще всего, продуктами распада белков. Представителями самых «маленьких» пептидов являются дипептид карнозин (-аланилгистидин), содержащийся в мышцах животных и человека, итрипептид глутатион (-глутамилцистеинилглицин), который содержится во всех животных, растениях и бактериях.
Ряд пептидов играет важную биологическую роль. К ним можно отнести, например, декапептид, известный как грамицидин С – антибиотическое средство, гормоны гипофизаокситоцин, вазопрессин и адренокортикотропный гормон. Важнейшим полипептидом являетсяинсулин – гормон поджелудочной железы, снижающий содержание сахара в крови. Недостаток инсулина вызывает сахарный диабет.
Изучение пептидов проводилось, главным образом, как необходимая ступень при изучении белков. Таким образом, сформировались два аспекта химии пептидов: установление их строения и подход к их лабораторному синтезу. Для выяснения структуры конкретного пептида необходимо знать, какие аминокислоты входят в его состав, сколько имеется аминокислот каждого вида, какова последовательность соединения аминокислот.
Ответить на эти вопросы помогают чисто химические методы в сочетании с современными физико-химическими методами анализа.
Пептиды заданного строения невозможно синтезировать прямой конденсацией -аминокислот, так как уже при реакции только двух различных аминокислот образуются четыре различных дипептида. Кроме этого, пептидная связь, как всякая амидная, сравнительно легко гидролизуется и равновесие сильно смещено в сорону ее гидролиза, поэтому для синтеза пептидов применяются не сами аминокислоты, а их более реакционноспособные производные. Такой прием называютактивированием аминокислоты.
Синтез пептида с заданной последовательностью аминокислот возможен лишь при условии, что те аминные и карбоксильные группы, которые не должны участвовать в реакции, будучи заранее «защищены». Разумеется, защитные группировки должны легко удаляться, когда в них отпадает надобность.
Таким образом, для направленного синтеза пептидов заданного строения используют следующие приемы:
а) защита аминогруппы предыдущего компонента;
б) защита карбоксильной группы последующего компонента;
в) активация карбоксила предыдущего компонента (чаще) или аминогруппы последующего компонента (реже);
г) конденсация полученных производных;
д) снятие защиты, получение необходимого пептида.
Защитные группировки должны удовлетворять двум требованиям: легко вводиться и легко удаляться, когда в них отпадает надобность.
Синтез пептидов не только дает возможность получать новые представители этого класса соединений, но и открывает путь к синтезу сложных природных веществ – антибиотиков и белков. В настоящее время разработан ряд методов активации и защиты функциональных групп. Рассмотрим некоторые из них.

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter